Nos projets
Description
Depuis près de 40 ans, nous développons des produits médicaux et de soins de santé allant du masque chirurgical au système d’imagerie oncologique. Ce parcours nourrit notre passion pour les solutions offertes aux patients en vue d’améliorer leur qualité de vie.
Voir les projets
Développement de produits médicaux
Notre équipe multidisciplinaire évolue dans plusieurs contextes cliniques et de soins de santé
Depuis près de 40 ans, Alto développe des instruments médicaux et de soins de santé primés d’une complexité variable, allant des masques jetables aux systèmes d’imagerie pour dépister le cancer du sein.
L’expertise d’Alto dans le domaine médical se concentre sur les activités de développement de produit. Notre processus de design, supporté par l’ingénierie mécanique, permet d’alimenter vos processus internes de vérification et validation (V&V) ainsi que de certification. Nos activités s’adaptent à votre système de gestion de la qualité (Quality Management System QMS) pour rencontrer les exigences réglementaires de Santé Canada et de la FDA.
Quel que soit le champ d’application des produits médicaux, nous plaçons l’être humain au cœur de notre conception en considérant les besoins et les capacités des différents usagers (patients, opérateurs, spécialistes). Nos expertises combinées en design industriel, design d’interaction et génie mécanique garantissent la création de produits médicaux innovants, performants, ergonomiques et esthétiques.
activités réalisées
DÉVELOPPEMENT DE PRODUITS
- Preuve de concept
- Design industriel
- Design UX/UI front end
- Imagerie
- Ingénierie mécanique
- Maquettes, prototypes fonctionnels, prototypes cliniques
- Tests de vérification (V&V)
- BOM, Dessins d’assemblage et de fabrication
En collaboration avec les équipes du client et nos partenaires ISO 13485 :
FACTEURS HUMAINS (USAGE)
- Définition besoins utilisateurs
- Analyse de risques
- Études FMEA et FTA
- Tests de validation (V&V)
- Tests cliniques
GESTION DE QUALITÉ ET RÉGLEMENTAIRE
- Design inputs et outputs DI/DO
- Historique de design DHF
- Design reviews
- Prise en charge du processus et ébergement système qualité (QMS) via nos partenaires
- Prise en charge de la stratégie réglementaire et dépôts Santé canada et FDA via nos partenaires

DES PROJETS ANCRÉS DANS LA RÉALITÉ
Votre partenaire de preuve de concept
L’équipe d’Alto détient le savoir-faire pour soutenir le développement de vos idées et accélérer la création de votre preuve de concept en vue de soumettre à la FDA et à Santé Canada. La recherche contextuelle, le développement de concepts, ainsi que la fabrication de prototypes et les tests de vérification permettent de faire progresser les concepts de produits médicaux les plus audacieux.
En début de mandat, le point de vue du designer enrichit la définition des besoins utilisateurs (user needs) et intrants de design (design inputs). Par la suite, plusieurs tests de vérification et d’usage peuvent être réalisés rapidement grâce à nos capacités internes de prototypage et d’étude de facteurs humains, tandis que notre équipe de conception mécanique élabore modèles 3D et dessins de production. Au cours de ce processus, nous contribuons à la traçabilité des activités de développement en nous conformant à vos processus internes de documentation d’historique du design (Design History File, DHF).
Notre empathie et notre approche axée sur le terrain permettent de créer des produits médicaux qui ne cochent pas seulement une liste de conformités mais améliorent réellement les conditions de vie des patients et les conditions de travail des professionnels de la santé.
Afin de mieux comprendre la réalité des pratiques, nous favorisons la collaboration avec les hôpitaux, les cliniques, les universités et les incubateurs. Nous privilégions les observations sur le terrain et les entrevues avec les professionnels de la santé pour définir des cas d’usage (use cases) actualisés. Ce processus permet de préciser les conditions environnementales (espace disponible, bruit, luminosité, etc.) et opérationnelles définissant les caractéristiques de vos futurs produits.
Les étapes d’utilisation sont précisées sous forme de storyboard et de parcours utilisateur (user journey) pour vérifier auprès des acteurs concernés que tous les aspects de l’utilisation sont couverts, de l’opération à l’entretien (maintenance) des dispositifs. Ce type d’analyse permet également d’anticiper les potentielles erreurs d’usage ou situations dangereuses pour enrichir votre analyse de risques et assurer la sécurité des utilisateurs.
Au fur et à mesure que nous développons les caractéristiques de vos produits, nous consultons régulièrement les spécialistes des champs d’application concernés (subject matter expert) pour confronter nos idées aux conditions réelles d’usage.


















Voir tous les projets
Produit
Client
Industrie
Année

Ligne de produits THS
TECHNIMOUNT MEDICAL
Médical
2021
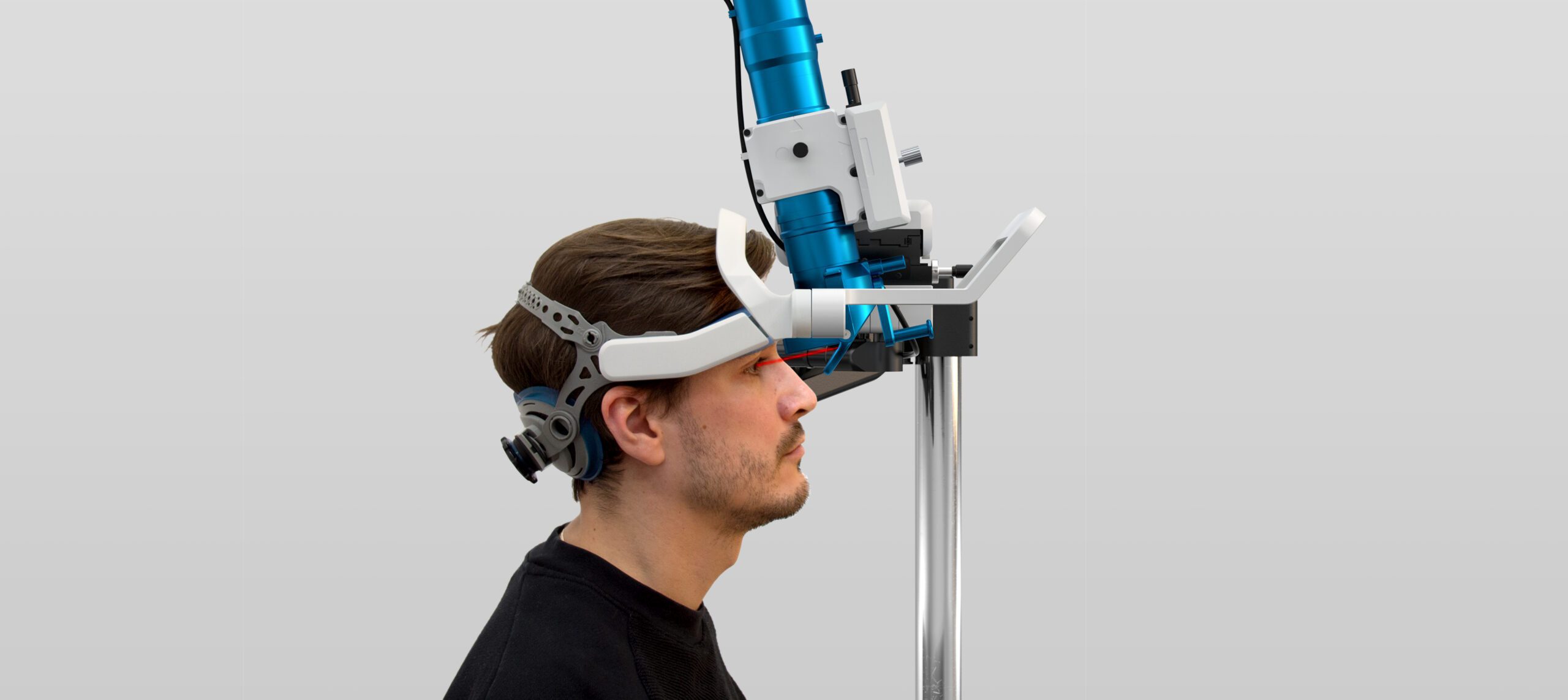
Système de distribution de lumière pour implant rétinien
Nano Retina
Médical
2015
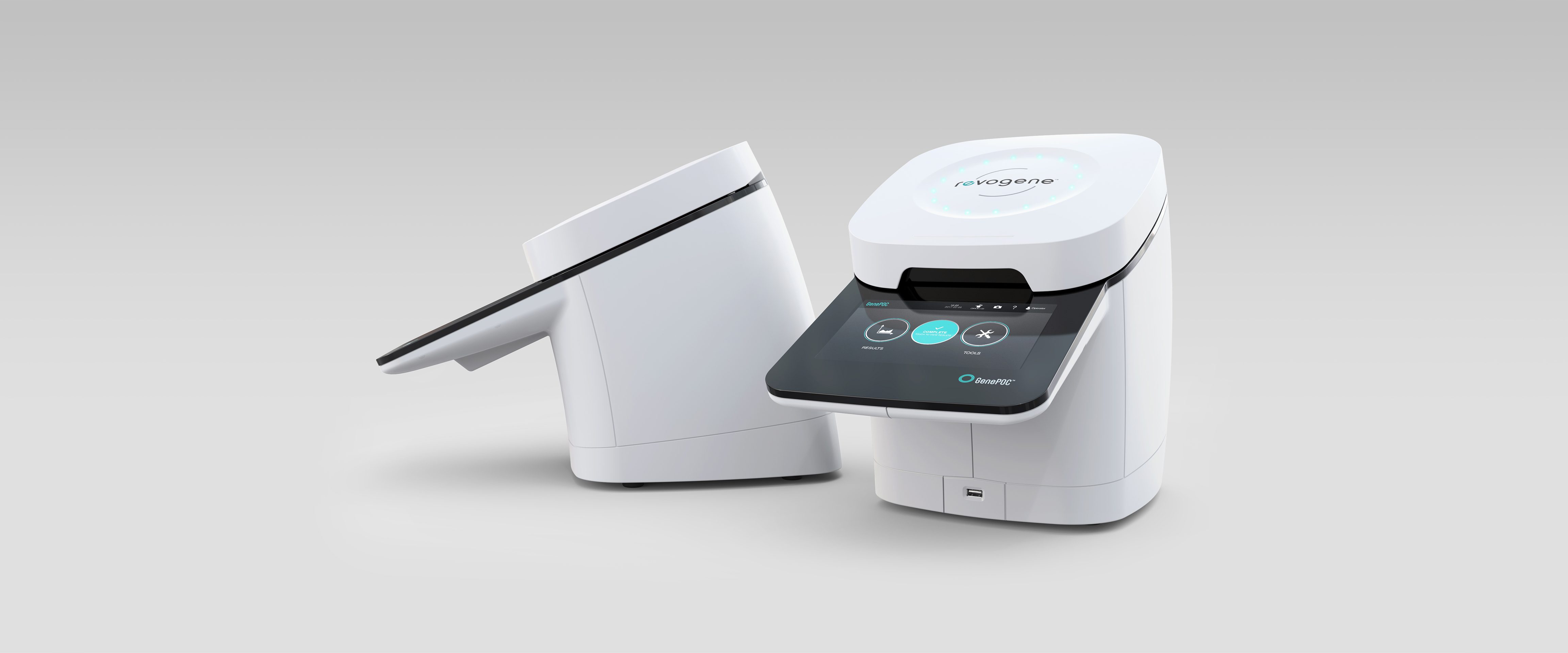
Revogene
Genepoc
Médical
2014
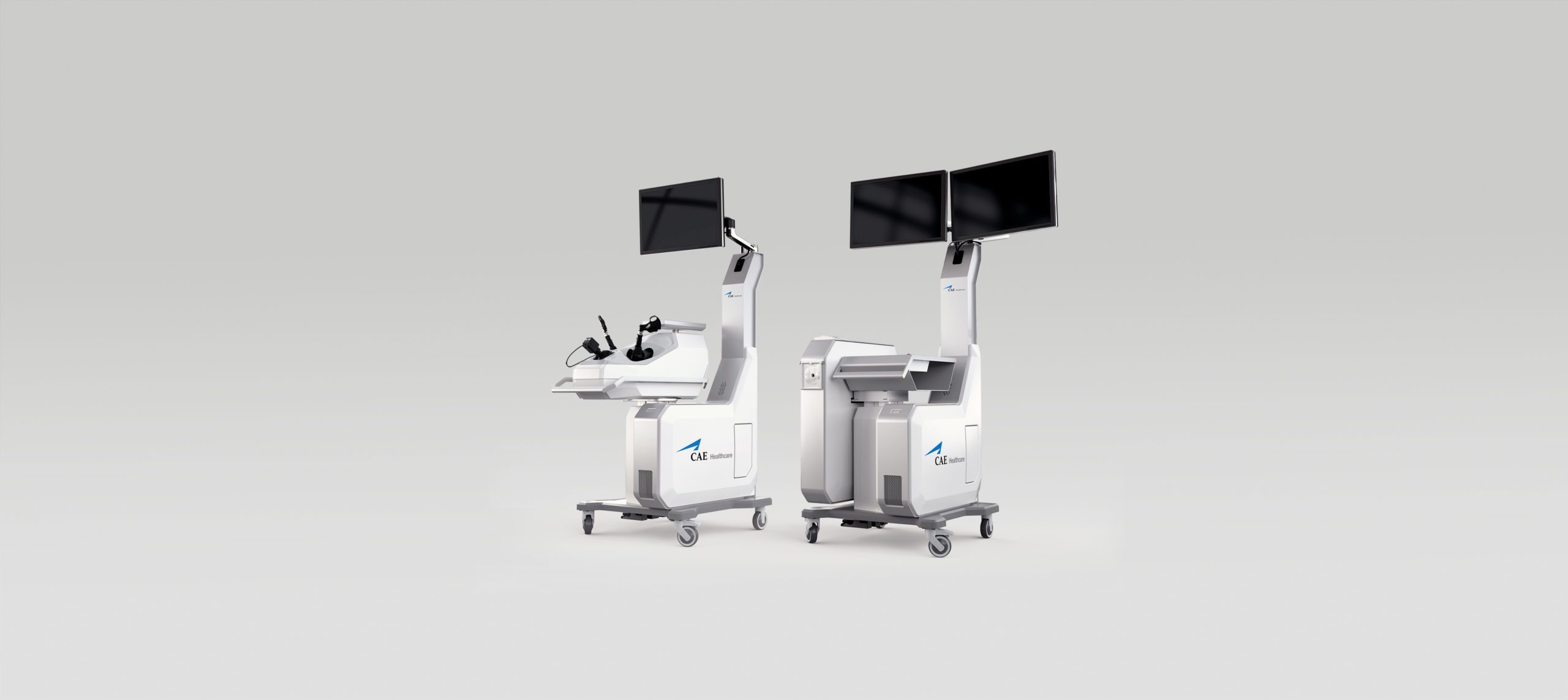
Simulateurs chirurgicaux
CAE Santé
Médical
2012

LabPET - Tomographe à émission de positrons
AMI – ADVANCED MOLECULAR IMAGING
Médical
2004